Увага!
Ми працюємо.
Надання послуг здійснюється за попереднім записом!
 |
проспект Литовський, 10 |
 |
вул. Новомостицька, 2 |
Принцип методу полімеразної ланцюгової реакції (ПЛР) був розроблений Керрі Муллісом у 1983 році. Відкриття ПЛР стало одним із найбільш видатних подій у галузі молекулярної біології за останні 20 років. За розробку ПЛР-аналізу К. Мулліс у 1993 році був удостоєний Нобелівської премії з хімії. Поява методу ПЛР була зумовлена певними досягненнями в області молекулярної генетики, насамперед розшифруванням нуклеотидної послідовності геномів ряду мікроорганізмів. Не можна не згадати й про те, що ПЛР стала можливою завдяки відкриттю унікального ферменту taq-ДНК-полімерази, який міститься у бактерій, що мешкають у гейзерах. Особливість цього ферменту полягає у його винятковій термостійкості (період напіврозпаду при 95 °С становить 40 хвилин) та високій робочій температурі – оптимум роботи 72 °С.
Вишуканість, простота виконання, неперевершені показники чутливості й специфічності принесли новому методу нечувану популярність. У короткий термін ПЛР-аналіз поширився по всьому світу. Діагностика інфекційних захворювань, у тому числі викликаних важко культивованими агентами, генотипування мікроорганізмів, оцінка їх вірулентності, визначення стійкості мікрофлори до антибіотиків, пренатальна діагностика, біологічний контроль препаратів крові – ось неповний перелік напрямів медицини, де успішно застосовується ПЛР.
Полімеразна ланцюгова реакція (ПЛР) – метод ампліфікації ДНК in vitro, за допомогою якого протягом кількох годин можна виділити та розмножити певну послідовність ДНК у мільярди разів. Можливість отримання величезної кількості копій одного строго визначеного фрагмента генома значно спрощує дослідження наявного зразка ДНК.
У основі методу ПЛР лежить природний процес – комплементарне достроювання ДНК-матриці, що здійснюється ферментом ДНК-полімеразою. Ця реакція називається реплікацією ДНК.
Природна реплікація ДНК включає кілька стадій:
1) Денатурація ДНК (розплетення подвійної спіралі, розходження ниток ДНК);
2) Утворення коротких дволанцюгових ділянок ДНК (затравок, необхідних для ініціації синтезу ДНК);
3) Синтез нового ланцюга ДНК (комплементарне достроювання обох ниток).
Відкриття термостабільної ДНК-полімерази (Taq-полімерази) з термофільних бактерій Thermis aquaticus, оптимум роботи якої знаходиться в межах 70–72 градусів, дозволило зробити процес реплікації ДНК циклічним і застосувати його для роботи in vitro. Створення запрограмованих термостатів (ампліфікаторів), які за заданою програмою здійснюють циклічну зміну температур, створило передумови для широкого використання ПЛР у клінічній лабораторній діагностиці. При багаторазовому повторенні циклів синтезу відбувається експоненційне збільшення числа копій специфічного фрагмента ДНК, що дозволяє з невеликої кількості матеріалу, який може містити одиничні клітини мікроорганізмів, отримати достатню кількість копій ДНК для їх ідентифікації методом електрофорезу.
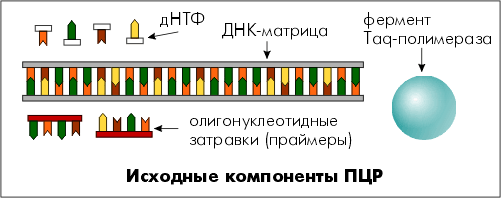
Комплементарне достроювання ланцюга починається не в будь-якій точці послідовності ДНК, а тільки у визначених стартових блоках – коротких дволанцюгових ділянках. При приєднанні таких блоків до специфічних ділянок ДНК можна спрямувати процес синтезу нової нитки лише у цій зоні, а не по всій довжині ДНК. Для формування стартових блоків використовують дві олігонуклеотидні затравки (приблизно 20 пар нуклеотидів), що називаються праймерами. Праймери комплементарні послідовностям ДНК на лівій і правій межах специфічного фрагмента та орієнтовані так, що синтез нової нитки ДНК відбувається лише між ними. Для отримання достатньої кількості копій потрібний 20–40 циклів ампліфікації.
Таким чином, ПЛР є процесом багаторазового збільшення числа копій (ампліфікації) специфічного фрагмента ДНК, який каталізується ферментом ДНК-полімеразою.
1 етап: Денатурація ДНК (розплетення подвійної спіралі). Проходить при 93–95 °C протягом 30–40 сек.
2 етап: Приєднання праймерів (відпал). Праймери комплементарно приєднуються до специфічних послідовностей на протилежних нитках ДНК. Температура відпалу для кожної пари праймерів індивідуальна та складає 50–65 °C. Тривалість – 20–60 сек.
3 етап: Достроювання ланцюгів ДНК. Комплементарний синтез відбувається від 5' кінця до 3' кінця нитки в протилежних напрямках, починаючи з точок приєднання праймерів. Матеріалом слугують дезоксинуклеотидтрифосфати. Реакція проходить при 70–72 °C. Тривалість – 20–40 сек.
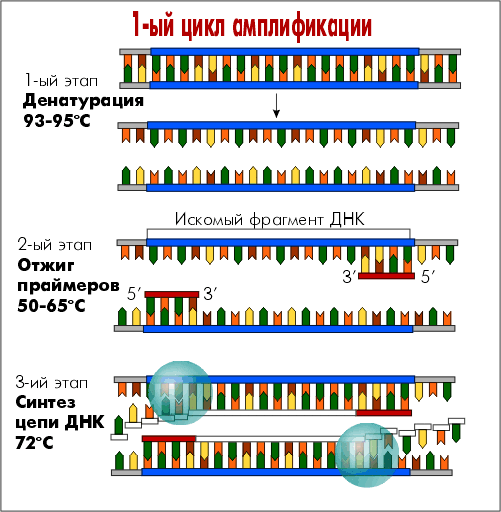
Новостворені ланцюги ДНК у першому циклі використовуються як матриці у наступному циклі, де формується специфічний фрагмент (амплікон). У наступних циклах амплікони стають матрицями для подальшого синтезу.

Так відбувається накопичення ампліконів у розчині за формулою 2ⁿ, де n — кількість циклів ампліфікації. Тому навіть якщо у зразку спочатку була лише одна молекула ДНК, за 30–40 циклів утворюється близько 10⁸ копій, достатніх для візуальної детекції методом електрофорезу.
1. Пряме визначення наявності збудників.
Багато традиційних методів виявляють білки-маркери, що є лише непрямою ознакою інфекції. ПЛР визначає саме ДНК збудника, що дає точний результат.
2. Висока специфічність.
Досягається завдяки тому, що визначається унікальна послідовність ДНК, притаманна лише конкретному мікроорганізму.
3. Висока чутливість.
Метод дозволяє виявити навіть одиничні клітини мікроорганізмів. Чутливість становить 10–100 клітин у пробі.
4. Універсальність.
Єдиний метод підходить для виявлення великої кількості збудників у різних видах біоматеріалу: слизу, сечі, крові, зішкрібів тощо.
5. Швидкість.
Повний аналіз займає 4–4,5 години.
6. Можливість діагностики латентних інфекцій.
Особливо цінний для виявлення внутрішньоклітинних та важкокультивованих мікроорганізмів.
Контамінація навіть слідовими кількостями ампліконів на обладнанні або поверхнях може спричинити систематичні хибнопозитивні результати.
Визначити джерело контамінації зазвичай дуже складно. Великий практичний досвід лабораторій дозволив сформувати вимоги до організації ПЛР-діагностики, що мінімізують ризики хибних результатів.
Пре-ПЛР-приміщення, де проводять обробку клінічних зразків, виділення ДНК, приготування реакційної суміші та постановку ПЛР. У цих приміщеннях заборонено виконувати інші роботи із збудниками, що діагностуються методом ПЛР.
Пост-ПЛР-приміщення — місце для детекції продуктів ампліфікації. Бажано розташовувати його якнайдалі від пре-ПЛР зони.
Метод ПЛР має величезне значення для діагностики інфекцій бактеріальної й вірусної природи. Особливо ефективний у виявленні важкокультивованих, атипових форм бактерій, внутрішньоклітинних паразитів та мікроорганізмів, здатних тривалий час персистувати в організмі хазяїна.
З будь-яких питань щодо здоров'я своїх тварин
ви можете звернутися в нашу клініку за адресою:
просп. Литовський, 10 А, тел: 098-598-57-28 з 10.00 до 20.00
вул. Новомостицька, 2, тел: 067-100-34-75 з 9.00 до 19.00
з 14.00 до 15.00 санітарна година
Ветеринарна клініка «УМКА»
www.umka-vet.com.ua