Увага!
Ми працюємо.
Надання послуг здійснюється за попереднім записом!
 |
проспект Литовський, 10 |
 |
вул. Новомостицька, 2 |
Чи можливе кількісне визначення того чи іншого компонента в сироватці крові, рослинному соку, культуральній рідині від мікроорганізмів, клітинному гомогенаті, витяжці з зразка ґрунту, що містять сотні й тисячі різних компонентів? Можливе, але за однієї умови: аналізований компонент повинен мати властивості антигена, тобто здатність викликати в організмі людини або тварин синтез особливих білків – антитіл, які з високою специфічністю зв’язують антиген. Розв’язання таких задач — сфера імуноферментного аналізу (ІФА). Однак попередньо необхідно отримати очищений антиген, відповідне антитіло і підібрати фермент як мітку для антитіла або антигена.
І тоді можна провести імунохімічні реакції:

У першому варіанті (рівняння (1)) з антигена Аг, що міститься в тестованому зразку, і міченого антитіла Ат*, доданого в концентрації, що перевищує концентрацію Аг, утворюється комплекс Аг—Ат*. Кількісний аналіз реакції (1) може бути проведений за утворенням комплексу Аг—Ат*, який детектується за допомогою ферментної мітки, або за Ат*, що залишилося у вільному стані. Це неконкурентний варіант ІФА. У другому варіанті (рівняння (2)) лімітуючим субстратом є антитіло Ат. Мічений антиген Аг*, будучи доданим до аналізованого зразка у відомій концентрації, зв’язується з антитілом, утворюючи комплекс Аг*—Ат. У цій реакції Аг* буде конкурувати з неміченим антигеном Аг, що міститься в зразку. Концентрація Аг*—Ат буде обернено пропорційною концентрації Аг. Таким способом за заздалегідь відомою концентрацією Аг* можна визначити невідому концентрацію Аг. Це конкурентний варіант ІФА. В обох варіантах ІФА треба розв’язати важливе завдання — відокремити зв’язану фракцію міченого реагенту (Аг—Ат* або Аг*—Ат) від незв’язаного, вільного реагенту (Ат* або Аг*), щоб визначити частку специфічного зв’язування.
Набори імунохімічних реагентів для визначення антигенів називаються діагностикумами. Для їх створення необхідно розв’язати завдання одержання антигена, антитіла, комплексу антигена або антитіла з ферментом, налагодити реєстрацію імунохімічної реакції за активністю фермента, використаного як мітку. Поряд із ферментами як мітки для антигенів використовують радіоактивні та флуоресцентні сполуки: відповідно радіоімунний та флуоресцентно-імунний аналіз (РІА і ФІА). Перевагу надають ІФА, оскільки він не потребує складної вимірювальної апаратури та застосування радіоактивних сполук, а тому безпечний і придатний у польових умовах.
Імунохімічний аналіз не обмежується ІФА, РІА і ФІА, що ґрунтуються на прямій взаємодії антигена з антитілом. Існують методи виявлення і кількісного визначення антигенів за зміною їх фізичного стану при взаємодії з антитілами. Так, якщо антиген розташований на поверхні бактеріальних клітин, антитіла викликають їх злипання (аглютинацію). На такому принципі ґрунтується визначення груп крові: склеювання еритроцитів при взаємодії поверхневих антигенів з доданими антитілами (гемаглютинація). Антитіла, додані у певному співвідношенні до розчину високомолекулярних антигенів, викликають їх преципітацію – утворення великих, візуально виявлюваних агрегатів з молекул антигена, зв’язаних антитілами. Існують методи, засновані на реакції преципітації в гелях: при утворенні імунних комплексів Аг–Ат у гелі виникають лінії преципітації, за формою яких можна судити про кількість та імунологічну спорідненість антигенів. Для ідентифікації білків широко застосовується імуноблотинг: спочатку суміш білків розділяють за допомогою електрофорезу в гелі, потім на гель накладають нітроцелюлозну мембрану і на неї електрофоретично переносять (піддають електроблоттингу) розділені білки, які ідентифікують за допомогою мічених антитіл. Мічені антитіла широко використовують у дослідженні локалізації компонентів клітин і тканин – це методи імуноцито- та імуногістохімії. Клітини, мічені флуоресцентними антитілами, можна відділити від немічених клітин – метод проточної цитофлуориметрії.
Хроматографічні колонки з сорбентом, з яким ковалентно зв’язаний антиген (або антитіло), використовуються в афінній хроматографії – відділенні відповідного антитіла (або антигена) зі сумішей у результаті утворення імунних комплексів (див. розділ "Антитело"). Ще одне застосування імунохімічного аналізу – імуносенсори: п’єзокристал, вкритий антигеном (антитілом), у результаті зв’язування антитіл (антигена) збільшує свою масу і змінює частоту резонансних коливань у змінному електричному полі, що дає змогу реєструвати зміну маси п’єзоелектрика порядку 10-12 г.
Таким чином, ІФА — це лише один із способів визначення антигенів, що отримав широке практичне поширення завдяки можливості кількісних визначень, високій чутливості та комерційній доступності. У науково-дослідній роботі ці можливості імунохімічних методів завжди використовуються разом з ІФА і навіть із застосуванням одних і тих самих реагентів. Розгляд усієї сукупності цих методів фізично неможливий у межах однієї статті. Тому дана робота обмежується ІФА.
Як антиген можуть виступати клітини мікроорганізмів, віруси, білки і полісахариди. Це повноцінні антигени. Антитіла утворюються не проти всієї молекули білка або бактеріальної клітини, а тільки до невеликих ділянок на їх поверхні — антигенних детермінант (епітопів). Такі ділянки у білків містять не менше п’яти амінокислотних залишків. Антигенні детермінанти розгалужених молекул полісахаридів представлені ланцюжками з чотирьох–шести залишків.
Існують також неповноцінні антигени — гаптени. Антитіла до гаптенів утворюються лише за їх фіксації на полімерній матриці, як правило, на білках, полімерах клітинних стінок бактерій, синтетичних поліелектролітах. Таким способом можна отримати антитіла до антибіотиків та інших лікарських сполук, стероїдних і пептидних гормонів, вітамінів, пестицидів і навіть до такого простого з’єднання, як 2,4-динітрофенол. Гаптени представлені не лише низькомолекулярними сполуками. Так, нуклеїнові кислоти самі по собі неімуногенні. Проте антитіла до нуклеїнових кислот синтезуються, якщо вони знаходяться в комплексі з білками. Антигенні детермінанти нуклеїнових кислот — три- і тетрануклеотиди.
Часто виділити й очистити антиген, наприклад вірусний білок, буває складно. Адже його потрібно мати у відчутних кількостях, якщо йдеться про створення діагностикуму. У таких випадках для синтезу антигена використовують генно-інженерні (трансгенні) бактерії або дріжджі.
Антитіла отримують шляхом імунізації тварин відповідним антигеном: у лабораторних умовах це миші, морські свинки, кролі, у виробництві — вівці, кози, коні. Придатні також кури: антитіла після імунізації виділяють із жовтків яєць.
Імунна відповідь (див. [1, 2]) на введення одного антигена супроводжується синтезом антитіл, що відрізняються за структурою і функціональним призначенням (імунна система організму ешелонована: існує кілька ліній захисту від проникнення антигена). Це імуноглобуліни (Ig) класів G, D, E, A, M, з яких перші три можуть зв’язати по дві молекули антигена, тобто двовалентні, IgA чотири- або восьмивалентні, IgM — десятивалентні. З огляду на те, що антиген, який використовують для імунізації тварини, містить не одну, а кілька антигенних детермінант, можна уявити, яка множина антитіл виробляється в організмі у відповідь на введення одного антигена. Такі антитіла називають поліклональними. Вони гетерогенні за спорідненістю до антигенів. Їх склад непостійний і залежить від виду тварини, її генетичних особливостей і фізіологічного стану.
Для очищення та стандартизації поліклональних антитіл використовують афінну хроматографію. Сироватку крові від імунізованої тварини пропускають через колонку з полісахаридними кульками, до яких ковалентно пришитий антиген.
Специфічні антитіла зв’язуються антигеном, усі інші білки, у тому числі антитіла з низькою спорідненістю до антигена, проходять крізь колонку, після чого специфічно зв’язані антитіла змивають з колонки кислим або лужним розчином: зв’язок антигена з антитілом нековалентний. Один цикл афінної хроматографії дозволяє очистити білки у 1000 разів і більше.
Однак навіть такий спосіб очищення не дає змоги повністю позбутися гетерогенності препарату антитіл. Вихід із цього ускладнення — отримання антитіл з однією специфічністю, що реагують лише з однією антигенною детермінантою. Такі антитіла називаються моноклональними (див. [3]). Їх отримують методами клітинної інженерії шляхом гібридизації імунокомпетентних В-лімфоцитів і клітин мієломних пухлин, здатних до швидкого розмноження, необмеженого числом поділів (на відміну від більшості нормальних клітин, у яких число поділів обмежене). Препарати моноклональних антитіл характеризуються постійністю складу й фізико-хімічних властивостей, низькою ймовірністю перехресної реакції з "чужими" антигенами. Це високотехнологічний продукт. Його недолік — часто порівняно низька спорідненість до субстрату, низька афінність.
Необхідно підібрати такий фермент, який тривало зберігає свою активність, не втрачає її при операції зв’язування з антигеном або антитілом, має високу специфічність до субстрату. Широко використовуються пероксидаза хрону, лужна фосфатаза і β-галактозидаза Escherichia coli. Перспективні люциферази світлячків і світних бактерій. Активність ферментів детектують за зміною оптичної щільності, флуориметрично та електрохімічно. Люциферазні реакції супроводжуються випромінюванням фотонів, тому їх реєструють за біолюмінесценцією. Кілька прикладів.
Пероксидаза каталізує реакцію
![]()
Як AH2 можуть використовуватись різні сполуки. Так, відновлений безбарвний о-фенілендіамін у пероксидазній реакції перетворюється на окиснену забарвлену форму з максимумом оптичного поглинання при 435 нм, що реєструється фотометрично.
Лужна фосфатаза каталізує гідроліз фосфорних ефірів: 4-нітрофенілфосфат перетворюється на 4-нітрофенол, який реєструють за оптичною щільністю при 405 нм; 4-метилумбеліферал-фосфат перетворюється на 4-метилумбеліферон, що флуоресціює з високим квантовим виходом при 450 нм (флуоресценцію збуджують при 365 нм).
β-Галактозидаза каталізує гідроліз лактози з утворенням глюкози й галактози. Якщо замість природного субстрату взяти 4-метилумбеліферил-β-D-галактозид, при гідролізі утворюються галактоза і 4-метилумбеліферон, який реєструють флуориметрично.
У люциферазних реакціях детектують біолюмінесценцію:
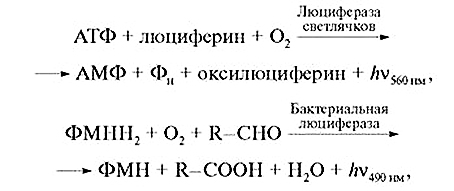
де АТФ — аденозинтрифосфат, АМФ — аденозинмонофосфат, Фн — ортофосфат, ФМН і ФМНН2 — окиснена та відновлена форми флавінмононуклеотиду, R—CHO і R—COOH — жирний альдегід і відповідна кислота.
Як зв’язати фермент з антитілом або антигеном без втрати активності ферменту і порушення властивостей антитіла та антигена? Для цього існує три групи методів: біохімічні, імунологічні та генно-інженерні.
У біохімічних методах використовується зшивання ферменту E з антитілом або антигеном за участю вільних реакційно здатних груп: —NH2, —COOH, —SH, —OH. Наприклад.

Якщо пряме взаємодію реалізувати не вдається, використовують біфункціональні зшиваючі агенти: глутаровий діальдегід, п-бензохінон. Функціональні групи реагентів можуть бути активовані. Так, гідроксигрупи у вуглеводному компоненті пероксидази хрону можна окислити перйодатом натрію до альдегідних, через які потім пришивають антиген або антитіло за участю аміногруп з утворенням основи Шиффа:

Вітамін біотин виключно міцно зв’язується з яєчним білком авідином — інгібітором біотин-вмісних ферментів: константа зв’язування в реакції авідин (А) + біотин (Б) —► комплекс АБ, що визначається з рівняння K1 = [АБ]/[А] • [Б], становить ~1015 М-1. Якщо приготувати комплекси Аг-біотин і авідин-E, а потім змішати їх, утвориться комплекс Аг-біотин-авідин-E.
Імунологічні методи отримання антигенів або антитіл, мічених ферментами, ґрунтуються на застосуванні антитіл або їх складових як зшиваючих ланок. Антитіла всіх п’яти класів побудовані за єдиним планом. На рис. 1 показані імуноглобуліни класу G. Антитіло побудовано з чотирьох поліпептидних ланцюгів: двох важких (H — від англ. heavy — важкий) і двох легких (L — light — легкий) з молекулярними масами відповідно 50 і 25 кДа. Важкі ланцюги зв’язані між собою двома дисульфідними зв’язками через залишки цистеїну. Легкі ланцюги утворюють з важкими по одній дисульфідній зв’язці. Обидва ланцюги складаються з доменів приблизно по 110 амінокислотних залишків у кожному: у важкому ланцюзі — чотири, в легкому — два домени. N-кінцеві домени H- і L-ланцюгів, позначувані VH і VL (V від variable — варіабельний), визначають специфічність антитіл, їх первинна структура варіабельна. Решта доменів характеризуються постійністю структури та позначаються CH1, CH2, CH3 і CL (C від constant — константний). За формою молекула антитіла нагадує букву Y, ніжка якої шарнірним сегментом з’єднана з відростками.
У дослідженні структури антитіл застосовуються протеолітичні ферменти. Папаїн розщеплює молекулу на три фрагменти. Два з них ідентичні, одновалентні в реакції зв’язування антигена і названі Fab-фрагментами (Fab — Fragment antigen binding — фрагмент, що зв’язує антиген). Третій фрагмент антиген не зв’язує, легко кристалізується й тому названий Fc-фрагментом (Fc — Fragment crystallizable — кристалізований фрагмент). Пепсин розщеплює молекулу антитіла по-іншому. При цьому утворюється двовалентний F(ab')2-фрагмент і кілька уламків Fc-фрагмента, з яких найбільший названо pFc'-фрагментом.
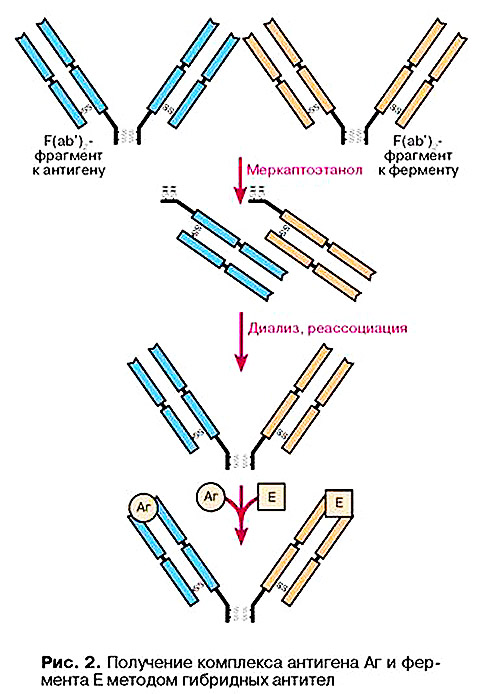
Метод гібридних антитіл для зшивання антигена з ферментом включає кілька етапів (рис. 2): одержання F(ab')2-фрагментів до антигена і ферменту шляхом обробки відповідних антитіл пепсином, їх роз’єднання шляхом відновлення дисульфідних зв’язків меркаптоетанолом, змішування отриманих Fab-фрагментів, видалення меркаптоетанолу діалізом, що веде до реасоціації з утворенням гібридних F(ab')2-фрагментів, які зв’язують антиген і фермент в єдиний комплекс.
Fc-фрагменти антитіл утворюють міцний комплекс з білком А стафілокока. За наявності антитіл до ферменту і кон’югата білок А–антиген можна отримати комплекс Е–Ат–білок А–Аг.
Генно-інженерний метод отримання міченого антигена ґрунтується на синтезі гібридних білків за допомогою мікроорганізмів. Таким методом, із використанням трансгенної E. coli, у лабораторії Б.С. Северина отримано гібридні білки, що містять повну амінокислотну послідовність бактеріальної β-галактозидази і специфічну послідовність білка від вірусу імунодефіциту людини або вірусу гепатиту B.
Збереження нативної структури й функції зшиваних реагентів залежить від їх індивідуальних особливостей, тому тут не може бути застосований якийсь єдиний стандартний прийом. Конкретний метод зшивання підбирається індивідуально.

Кількісний аналіз імунохімічних реакцій (див. рівняння (1) і (2)) може бути проведений за продуктами (Аг—Ат* і Аг*—Ат) або за субстратами реакцій, що залишилися у вільному стані (Ат* і Аг*). Для цього використовують два основних підходи.
Перший підхід — спрямований вплив на ферментативну активність комплексу Аг—E через зв’язане Ат, що веде до гальмування або, навпаки, до зростання швидкості ферментативної реакції (див. розділ "Гомогенный ИФА"). Такий ІФА може бути реалізований в однофазній системі — у розчині, і тому називається гомогенним або рідкофазним. Це ІФА без попереднього фізичного розділення мічених лігандів (Ат* або Аг*) від їх імунохімічних комплексів — продуктів реакцій (1) і (2).
Другий підхід — фізичне розділення за допомогою твердої фази, що зв’язує мічений реагент. Це гетерогенний або твердофазний ІФА. Як тверду фазу використовують стінки лунок у посуді, в якому проводиться аналіз. Цей посуд виготовляється у вигляді спеціальних планшетів із непористих прозорих полімерних матеріалів: полістиролу, полівінілхлориду, полиметакрилату. Білки (антигени або антитіла) адсорбуються на поверхні пластику — і в цьому основа твердофазного ІФА. Для збільшення міцності зв’язування білків пластик піддається модифікації (здійснюється обробка глутаровим альдегідом, полі-L-лізином, толуол-2,4-диизоціанатом; спосіб модифікації — ноу-хау фірми–виробника) таким чином, що активована поверхня набуває здатності до ковалентного зв’язування білків. До режиму модифікації висувають жорсткі вимоги: однорідність зв’язувальних властивостей поверхні пластику, його оптична прозорість (результати ІФА реєструються фотометрично). Після завершення процедури зв’язування з поверхнею пластику незв’язаний мічений реагент просто змивається з поверхні планшета. В англомовній літературі твердофазний ІФА називається ELISA (enzyme-linked immunosorbent assay) — визначення ферменту, зв’язаного з імуносорбентом.
У межах обох підходів існує багато варіантів. Розглянемо кілька прикладів.
Антитіло, утворюючи комплекс з антигеном, пригнічує активність зв’язаного ферменту: комплекс Аг—E, подібно до вільного E, каталізує перетворення субстрату S у продукт реакції P
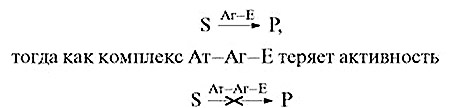
Втрата активності може бути викликана зміною конформації молекули ферменту, що веде до порушення структури його активного центру. Інша причина — фермент не може проявити активність, оскільки антитіло закрило доступ субстрату до активного центру ферменту.
Якщо додати вільний антиген, то він, конкуруючи за Ат, викликає регенерацію Аг—E, з’являється активність ферменту:
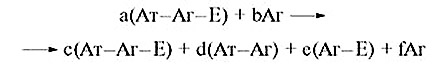
За наявності калібрувальної кривої, побудованої з використанням відомих концентрацій міченого і неміченого антигена (графік буде являти собою лінійну залежність між концентрацією Аг і ферментативною активністю Аг—E), таким методом (конкурентного, гомогенного ІФА) можна визначити концентрацію антигена в досліджуваному зразку.
Поряд із ферментами в гомогенному ІФА як мітки можуть бути використані модулятори (М) ферментів — речовини, здатні пригнічувати або стимулювати активність ферментів.
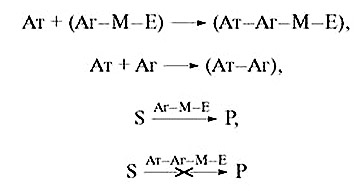

Комплекс Аг—М—Е каталитично активний, а будучи зв’язаним з Ат, неспроможний каталізувати реакцію. Вільний Аг, що міститься в тестованому зразку, конкуруючи з Аг—М—E за зв’язування з Ат, доданим у лімітованій кількості, веде до збільшення концентрації Аг—М—E і тим самим сприяє перебігу ферментативної реакції. Це варіант з позитивним модулятором ферменту. Навпаки, з негативним модулятором активність ферменту буде знижуватись у міру зростання вільного Аг в тестованому зразку.
Існує багато інших модифікацій гомогенного ІФА. Назвемо ще три з них: застосування як мітки простетичної групи ферментів, ковалентно зв’язаної з Аг; комплексів флуорогенних субстратів (S) ферменту з Аг (на відміну від Аг—S комплекс Ат—Аг—S не може служити субстратом ферменту, в результаті ферментативної реакції утворюється інтенсивно флуоресціюючий продукт); застосування антитіл, які, зв’язуючись з активним центром ферменту, інгібують його активність. Час, за який проводиться гомогенний ІФА, не перевищує 5 хв. Хоча гомогенному ІФА притаманні швидкість і невелика трудомісткість, він характеризується нижчою чутливістю порівняно з гетерогенним ІФА.
Антитіла Ат зв’язуються зі стінками лунки на полістироловому планшеті (рис. 3,а). Надлишок Ат змивають буферним розчином. Залишені незайнятими ділянки зв’язування на поверхні полістиролу блокують додаванням стороннього білка, наприклад бичачим сироватковим альбуміном; поверхню знову відмивають (на рис. 3,а не показано). Зразок, що містить антиген Аг в невідомій концентрації, змішують з певною кількістю міченого антигена і додають до антитіл, фіксованих на полістироловій підкладці. Аг і Аг—Е конкурентно зв’язуються з Ат. Поверхню полістиролу знову відмивають для видалення незв’язаних Аг і Аг—E. Після цього визначають активність ферменту в лунці полістиролового планшета, яка буде обернено пропорційною концентрації антигена в досліджуваному зразку. Це конкурентний гетерогенний ІФА.
На рис. 3,б показаний інший варіант гетерогенного ІФА — неконкурентний, так званий метод "сендвіча". На поверхні полістиролу сорбують антитіла Ат1, що зв’язують Аг (він повинен мати щонайменше дві валентності) з тестованого зразка. Потім додають другі антитіла Ат2, зшиті з ферментом E. Після видалення надлишку Ат2—E до лунки полістиролового планшета додають субстрат реакції і визначають активність ферменту, яка буде лінійно залежати від концентрації Аг у зразку.
За допомогою спеціального спектрального приладу результати ферментативної реакції в полістиролових планшетах можна виміряти за одну хвилину у 96 лунках. Проте загалом гетерогенний ІФА триваліший за гомогенний. Його проведення потребує до 3–4 годин, оскільки на кожному етапі операцій має встановитися рівновага, і лише після цього можна проводити відмивання імуносорбенту, що теж займає час.
Чутливість ІФА така, що визначення речовин у концентраціях 10-9–10-12 М, білка в мікро–нано грамах в 1 мл — звичайна справа. Подібно до того, як око людини реєструє одиничний квант світла, ІФА можна вдосконалити так, що він за допомогою каскадних систем підсилення дозволить виявляти одиничні молекули аналізованої речовини.
Можливості підвищення чутливості обмежуються фоном аналізованого з’єднання (тобто його наявністю не тільки в досліджуваному зразку, а й у використаних реактивах і розчинниках), субстратною специфічністю ферменту та афінністю антитіл. До обмежень ІФА належить також наявність у тестованих зразках кофакторів, інгібіторів і стимуляторів активності ферментів. Ще один недолік — ІФА не дозволяє розрізняти нативні білки та їх біологічно неактивні фрагменти, що зберегли антигенні детермінанти. Перешкодою для ІФА може бути зміна каталитичної активності ферменту при його кон’югуванні з антигеном. Обмеженням ІФА є його застосовність лише до добре вивчених систем, де є очищені антигени і високо специфічні антитіла.
Висока чутливість у поєднанні зі швидкістю аналізу (від кількох хвилин до кількох годин), можливістю одночасного тестування великої кількості зразків і відсутністю особливої потреби в попередніх операціях з очищення і концентрування аналізованого з’єднання в зразку надають ІФА беззаперечні переваги перед іншими аналітичними методами. Тому сьогодні ІФА знаходить широке застосування в охороні здоров’я, різних галузях сільського господарства, промисловій біотехнології, природоохоронній діяльності та науково-дослідній роботі.
Будь-яке захворювання людини й тварин можна швидко і точно діагностувати шляхом ідентифікації збудника, його окремих антигенних компонентів, антитіл до цих компонентів або речовин, не властивих здоровому організму й синтезованих при його патологічних станах (рак, серцево-судинні та ендокринні захворювання). Диспансеризація населення, епідеміологічні обстеження, виявлення отруєнь, наявності наркотиків у крові, визначення вмісту лікарських сполук у тканинах, вірусні хвороби рослин, визначення антибіотиків, вітамінів та інших біологічно активних сполук при відборі активних штамів-продуцентів у промисловій біотехнології, контроль якості медичних препаратів із донорської крові на відсутність вірусів–збудників СНІДу і гепатиту B — це лише невеликий перелік практичного застосування ІФА. Сучасні фундаментальні дослідження в біохімії, клітинній фізіології та імунології, мікробіології, вірусології, онкології важко уявити без ІФА. Реагенти для проведення ІФА сьогодні стали комерційними продуктами і можуть бути придбані за каталогами відомих фірм.
ЛІТЕРАТУРА
1. Абелев Г.І. Основи імунітету // Соросовський освітній журнал. 1996. № 5. С. 4—10.
2. Галактіонов В.Г. Як працює імунна система // Там само. 1997. № 12. С. 2—9.
3. Абелев Г.І. Моноклональні антитіла // Там само. 1998. № 1. С. 16—20.
4. Березін І.В. та ін. Біотехнологія / Ред. Н.С. Єгоров, В.Д. Самуїлов. М.: Вищ. шк., 1987. Кн. 8: Інженерна ензимологія.
5. Єгоров А.М. та ін. Теорія і практика імуноферментного аналізу. М.: Вищ. шк., 1991.
6. Імуноферментний аналіз / Ред. Т.Т. Нго, Г. Ленхофф. М.: Мир, 1988.
В. Д. САМУЇЛОВ
Московський державний університет
ім. М.В. Ломоносова
Віталій Дмитрович Самуїлов, доктор біологічних наук, професор кафедри клітинної фізіології та імунології МДУ. Сфера наукових інтересів – біоенергетика, мікробіологія, біотехнологія, імунологія. Автор понад 200 статей, монографії та трьох навчальних посібників.
З будь-яких питань щодо здоров'я своїх тварин
ви можете звернутися в нашу клініку за адресою:
просп. Литовський, 10 А, тел: 098-598-57-28 з 10.00 до 20.00
вул. Новомостицька, 2, тел: 067-100-34-75 з 9.00 до 19.00
з 14.00 до 15.00 санітарна година
Ветеринарна клініка «УМКА»
www.umka-vet.com.ua